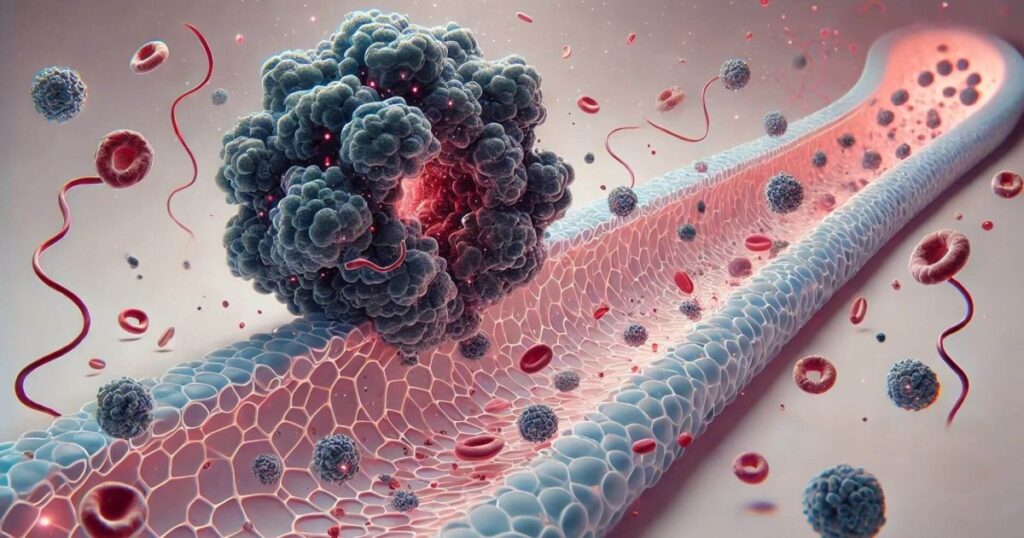
La metástasis es la principal causa de muerte por cáncer, pero entender cómo empieza sigue siendo un desafío. Ahora, un estudio publicado en iScience presenta un modelo tridimensional innovador que permite observar, en tiempo real, cómo los clústeres de células tumorales penetran las paredes de los vasos sanguíneos. Este sistema, diseñado por investigadores japoneses, simula la interfaz entre un tumor y la microvasculatura con una precisión sin precedentes.
El dispositivo combina organoides tumorales derivados de tejido intestinal con vasos artificiales cultivados en un chip. Este «tumor-microvaso en chip» permite ubicar los tumores cerca de los vasos y registrar sus interacciones con imagenología avanzada. Por primera vez, se observa la intravasación de células cancerosas como un proceso colectivo: las células migran en grupo, invaden el vaso y se dispersan dentro del lumen.
La disrupción de la pared vascular no es pasiva, sino inducida por el tumor. Las células endoteliales sufren una transición hacia un fenotipo mesenquimal (EndoMT), perdiendo cohesión y permitiendo la intrusión tumoral. Esta transición es desencadenada por citoquinas como TGF-β y activina, producidas por el propio tumor y el endotelio circundante.
El resultado: un clúster cohesivo entra al torrente sanguíneo, listo para colonizar otros órganos. Este mecanismo, que había sido hipotetizado, se confirma ahora visualmente con una resolución sin precedentes, lo que abre nuevas oportunidades para frenar la metástasis desde su inicio.

Clústeres tumorales: una amenaza mayor que las células individuales
No todas las células tumorales que circulan en la sangre tienen el mismo potencial metastásico. Los clústeres (conjuntos de células que permanecen unidas) presentan una ventaja: sobreviven mejor en la sangre, resisten la acción del sistema inmunitario y tienen mayor capacidad de establecer metástasis.
Este estudio revela cómo estos clústeres acceden a los vasos: mediante una intravasación dirigida y coordinada. Las células se organizan, migran en bloque y activan mecanismos moleculares para debilitar la barrera endotelial justo donde van a ingresar.
El proceso observado incluye la formación de invadopodios (prolongaciones celulares que degradan matriz extracelular). Esta estructura permite que las células tumorales atraviesen tejidos, generando un camino por el cual penetran el vaso.
La disrupción de la pared del vaso no es generalizada, sino localizada y temporal. Tras la intrusión, las células endoteliales intentan recuperar su integridad, pero el daño ya está hecho: el tumor ha enviado una avanzada hacia el resto del organismo.
Las señales moleculares que activan la entrada tumoral
El principal desencadenante de la intravasación es la liberación de citoquinas como TGF-β1, TGF-β2 y activina. Estas moléculas activan vías intracelulares en las células endoteliales que provocan la EndoMT: pierden uniones estrechas, ganan movilidad y se desorganizan.
La activación de EndoMT facilita el paso del tumor sin necesidad de destruir toda la vasculatura. Se crea una especie de «puerta temporal» en la pared del vaso por donde se infiltran los clústeres, sin desencadenar una inflamación extensa.
Cuando los investigadores bloquearon TGF-β con un receptor señuelo (TβRI-TβRII-Fc), el proceso se frenó drásticamente. La formación de invadopodios disminuyó, se redujo la expresión de marcadores mesenquimales y la pared vascular mantuvo su integridad.
La inhibición de activina (con follistatina) redujo la invasividad tumoral, pero no detuvo la EndoMT. Esto sugiere que TGF-β y activina actúan de forma complementaria, pero en mecanismos parcialmente independientes.

El modelo «tumor-microvaso en chip» representa una herramienta sin precedentes para estudiar la metástasis. A diferencia de los modelos tradicionales en 2D o de membrana porosa, este sistema reproduce la arquitectura tridimensional y la interacción tumoral realista con vasos.
Permite observar en tiempo real el momento exacto de la intravasación, con marcadores genéticos y visuales. Esta capacidad facilita el estudio de cada paso del proceso, desde la formación del clúster hasta su liberación en la luz del vaso.
Es también una plataforma para probar fármacos que frenen la metástasis. Inhibidores de TGF-β, moduladores del citoesqueleto o refuerzos de la barrera endotelial pueden evaluarse con precisión antes de pasar a modelos animales o ensayos clínicos.
El sistema puede adaptarse a distintos tipos de tumores y condiciones genéticas. Esto lo convierte en una herramienta versátil para comprender cómo distintas variantes de cáncer desencadenan la metástasis y cómo detenerla.
La posibilidad de intervenir justo antes de que el tumor entre al torrente sanguíneo es clínicamente transformadora. Si se puede evitar que los clústeres accedan al sistema circulatorio, se podría reducir drásticamente la diseminación y mejorar la supervivencia.
Terapias dirigidas podrían incluir inhibidores localizados de TGF-β o activina. También se podría fortalecer la pared de los vasos con moléculas que estabilicen uniones endoteliales o incluso usar biomateriales que impidan la infiltración tumoral.
Comprender que el proceso de intravasación es colectivo y dirigido cambia el paradigma terapéutico. Ya no basta con atacar células individuales: hay que bloquear la dinámica grupal y su capacidad de reorganizar el entorno.
Este tipo de avances también mejora los métodos de diagnóstico. Observar CTC clústers en sangre periférica podría usarse como indicador temprano de metástasis activa, guiando decisiones clínicas en tiempo real.

El estudio liderado por el equipo japonés ofrece una mirada directa y detallada de cómo los tumores invaden el sistema vascular. El modelo en chip revela el papel central de las células agrupadas, las señales moleculares que debilitan el endotelio y el momento exacto en que se inicia la metástasis.
Este conocimiento allana el camino hacia nuevas terapias anti-metastásicas. Bloquear el proceso de intravasación antes de que ocurra podría cambiar drásticamente el pronóstico de muchos tipos de cáncer.
La combinación de ingeniería, biología celular y análisis molecular abre una nueva era en la investigación oncológica. El futuro del tratamiento del cáncer podría estar en chips como este, donde se reproducen las condiciones reales del cuerpo humano para entender y anticipar la metástasis.
Referencias
- Ikeda Y, Kondo M, Matsunaga Y, et al. A tumor-microvessel on-a-chip reveals a mechanism for cancer cell cluster intravasation. iScience. (2025). doi:10.1016/j.isci.2025.112517
Fuente de TenemosNoticias.com: www.muyinteresante.com
Publicado el: 2025-05-29 11:03:00
En la sección: Muy Interesante